GECH-01 SOLVED PAPER JUNE 2024
01. उत्क्रमणीय एवं अनुत्क्रमणीय सेल क्या है? सेल का ई.एम.एफ. कैसे निर्धारण किया जाता है?
उत्क्रमणीय एवं अनुत्क्रमणीय सेल क्या है?
(1) उत्क्रमणीय सेल (Reversible Cell):
वह विद्युत रासायनिक सेल जिसमें होने वाली रासायनिक अभिक्रिया को बाहरी विद्युत प्रवाह की सहायता से विपरीत दिशा में कराया जा सकता है, उसे उत्क्रमणीय सेल कहते हैं। इस प्रकार के सेल में रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित किया जाता है और यह प्रक्रिया उलटी भी की जा सकती है। उदाहरण: हाइड्रोजन-ऑक्सीजन ईंधन सेल, डेनियल सेल (Daniell Cell)।
विशेषताएँ:
यह ताप और दबाव की थोड़ी-बहुत भिन्नता के प्रति संवेदनशील होता है।
इसमें संतुलन अवस्था प्राप्त की जा सकती है।
यह एक बैटरी के रूप में कार्य कर सकता है।
(2) अनुत्क्रमणीय सेल (Irreversible Cell):
वह विद्युत रासायनिक सेल जिसमें रासायनिक अभिक्रिया को बाहरी विद्युत प्रवाह से विपरीत दिशा में नहीं कराया जा सकता, उसे अनुत्क्रमणीय सेल कहते हैं। इस प्रकार के सेल में रासायनिक ऊर्जा को विद्युत ऊर्जा में तो बदला जा सकता है, लेकिन इसे पुनः पहले की अवस्था में नहीं लाया जा सकता। उदाहरण: सूखी सेल (Dry Cell), लेड-असिड बैटरी (Lead-Acid Battery)।
विशेषताएँ:
इसमें रासायनिक अभिक्रिया केवल एक ही दिशा में होती है।
एक बार उपयोग के बाद इसे पुनः रिचार्ज नहीं किया जा सकता।
इसका उपयोग प्राथमिक बैटरियों में किया जाता है।
सेल का ई.एम.एफ. (Electromotive Force, EMF) कैसे निर्धारण किया जाता है?
किसी विद्युत रासायनिक सेल का विद्युत वाहक बल (EMF) उस अधिकतम विभवांतर (Potential Difference) को कहते हैं जो सेल के इलेक्ट्रोड्स के बीच तब उत्पन्न होता है जब उसमें कोई धारा प्रवाहित नहीं हो रही हो। इसे निम्नलिखित तरीके से निर्धारित किया जा सकता है:
(1) नेर्न्स्ट समीकरण (Nernst Equation) का प्रयोग
नेर्न्स्ट समीकरण के अनुसार किसी विद्युत रासायनिक सेल का ई.एम.एफ. निम्नलिखित समीकरण द्वारा व्यक्त किया जाता है:
(2) स्टैंडर्ड इलेक्ट्रोड पोटेंशियल का प्रयोग
यदि किसी सेल के दो इलेक्ट्रोड का मानक इलेक्ट्रोड विभव (Standard Electrode Potential) ज्ञात हो, तो उसके द्वारा सेल का ई.एम.एफ. निम्नलिखित समीकरण से निकाला जा सकता है:
(3) वोल्टमीटर का प्रयोग
सेल के इलेक्ट्रोड्स को वोल्टमीटर से जोड़कर खुले परिपथ में उसका ई.एम.एफ. सीधे मापा जा सकता है।
निष्कर्ष
उत्क्रमणीय सेल में रासायनिक अभिक्रिया को उलटकर पुनः ऊर्जा उत्पन्न की जा सकती है, जबकि अनुत्क्रमणीय सेल में यह संभव नहीं होता।
सेल का ई.एम.एफ. नेर्न्स्ट समीकरण, स्टैंडर्ड इलेक्ट्रोड विभव, या वोल्टमीटर द्वारा मापा जा सकता है।
विद्युत रासायनिक सेल की दक्षता और उपयोगिता को समझने के लिए ई.एम.एफ. का निर्धारण आवश्यक है।
02. द्रव जंक्शन विभव पर एक नोट लिखें? इसे कैसे खत्म किया जाता है।
परिचय
द्रव जंक्शन विभव (Liquid Junction Potential) उस विभवांतर (Potential Difference) को कहते हैं, जो दो भिन्न इलेक्ट्रोलाइट समाधानों के बीच संपर्क (Junction) होने पर उत्पन्न होता है। यह प्रभाव तब उत्पन्न होता है जब आयनों का प्रवाह भिन्न-भिन्न गतिशीलता (Mobility) के कारण असंतुलित हो जाता है।
कारण
जब दो भिन्न सांद्रण या प्रकृति वाले इलेक्ट्रोलाइट एक-दूसरे के संपर्क में आते हैं, तो उनके धनायन (Cations) और ऋणायन (Anions) की गति दर (Mobility) समान नहीं होती। इसके कारण एक अस्थायी आवेश असंतुलन उत्पन्न होता है, जिससे एक छोटा विभवांतर बनता है, जिसे द्रव जंक्शन विभव कहते हैं।
उदाहरण
यदि एक हाइड्रोजन इलेक्ट्रोड को किसी अन्य इलेक्ट्रोड से जोड़ने के लिए दो भिन्न इलेक्ट्रोलाइट का उपयोग किया जाता है, तो उनके जंक्शन पर एक छोटा विभवांतर उत्पन्न हो सकता है।
द्रव जंक्शन विभव को कैसे समाप्त किया जाता है?
द्रव जंक्शन विभव को समाप्त या कम करने के लिए निम्नलिखित विधियाँ अपनाई जाती हैं:
सॉल्ट ब्रिज (Salt Bridge) का उपयोग
सॉल्ट ब्रिज (जैसे कि KCl या KNO₃ का संतृप्त घोल) का उपयोग करने से द्रव जंक्शन विभव को न्यूनतम किया जा सकता है।
यह समान गतिशीलता वाले आयनों (K⁺ और Cl⁻) को प्रदान करता है, जिससे विभव असंतुलन नहीं बनता।
उच्च गतिशीलता वाले इलेक्ट्रोलाइट का चयन
ऐसे इलेक्ट्रोलाइट का उपयोग किया जाता है जिसमें धनायन और ऋणायन की गतिशीलता लगभग समान हो, जैसे KCl, NH₄NO₃।
अर्ध-परगम्य झिल्ली (Semipermeable Membrane) का प्रयोग
कुछ विशेष विद्युत रासायनिक कोशिकाओं में अर्ध-परगम्य झिल्ली का उपयोग करके जंक्शन विभव को नियंत्रित किया जाता है।
संतुलित सांद्रण वाले इलेक्ट्रोलाइट का उपयोग
यदि दोनों इलेक्ट्रोलाइट समान सांद्रण के हों, तो आयनों के प्रसार में संतुलन बना रहता है और विभव न्यूनतम होता है।
निष्कर्ष
द्रव जंक्शन विभव एक अवांछनीय प्रभाव है जो विद्युत रासायनिक मापन की सटीकता को प्रभावित कर सकता है। इसे कम करने के लिए सॉल्ट ब्रिज, उचित इलेक्ट्रोलाइट चयन, और अर्ध-परगम्य झिल्ली जैसी तकनीकों का उपयोग किया जाता है।
02. (A) वे कौन से कारक है जो किसी अभिक्रिया की दर को प्रभावित करते हैं, समझाइए।
अभिक्रिया की दर को प्रभावित करने वाले कारक
रासायनिक अभिक्रिया की दर (Rate of Reaction) यह दर्शाती है कि किसी रासायनिक अभिक्रिया में प्रति इकाई समय में अभिकारकों (Reactants) की सांद्रता में कितनी कमी या उत्पादों (Products) की सांद्रता में कितनी वृद्धि हो रही है। किसी भी रासायनिक अभिक्रिया की दर निम्नलिखित कारकों पर निर्भर करती है:
1. अभिकारकों की प्रकृति (Nature of Reactants)
अभिकारकों के प्रकार पर निर्भर करता है कि वे कितनी जल्दी प्रतिक्रिया करते हैं।
आयनिक यौगिकों के बीच होने वाली अभिक्रियाएँ तेजी से होती हैं, क्योंकि आयन घोल में पहले से ही मुक्त होते हैं और तुरंत प्रतिक्रिया कर सकते हैं।
परमाण्विक या अणुगत यौगिकों के बीच होने वाली अभिक्रियाएँ अपेक्षाकृत धीमी होती हैं, क्योंकि उन्हें पहले बंधनों को तोड़कर पुनः बनाने की आवश्यकता होती है।
उदाहरण:
2. सांद्रता (Concentration of Reactants)
यदि अभिकारकों की सांद्रता अधिक होगी, तो उनकी आपसी टक्करों की संख्या बढ़ जाएगी, जिससे अभिक्रिया की दर अधिक होगी।
यह गुलद्वारा के नियम (Law of Mass Action) के अनुसार होता है, जो बताता है कि किसी अभिक्रिया की दर उसके अभिकारकों की सांद्रता के गुणनफल के समानुपाती होती है।
उदाहरण:
यदि HCl और NaOH के विलयन की सांद्रता बढ़ा दी जाए, तो तटस्थीकरण अभिक्रिया की गति तेज हो जाएगी।
3. तापमान (Temperature)
अभिक्रिया का तापमान बढ़ाने से कणों की गतिज ऊर्जा (Kinetic Energy) बढ़ती है, जिससे टक्करों की संख्या और उनकी ऊर्जा में वृद्धि होती है।
अरहेनियस समीकरण (Arrhenius Equation) के अनुसार, तापमान बढ़ाने से अभिक्रिया की दर बढ़ती है।
उदाहरण:
ठंडी परिस्थितियों में दूध जल्दी खराब नहीं होता, लेकिन गर्म मौसम में जल्दी खराब हो जाता है क्योंकि बैक्टीरिया की वृद्धि तेजी से होती है।
4. उत्प्रेरक (Catalyst)
उत्प्रेरक वह पदार्थ होता है जो अभिक्रिया की दर को तेज करता है लेकिन स्वयं अभिक्रिया में उपभुक्त नहीं होता।
उत्प्रेरक सक्रियण ऊर्जा (Activation Energy) को कम करता है और अभिक्रिया को तेजी से पूरा होने में सहायता करता है।
उदाहरण:
प्लैटिनम (Pt) अमोनिया संश्लेषण में उत्प्रेरक का कार्य करता है:
5. दाब (Pressure) (केवल गैसीय अभिक्रियाओं के लिए)
गैसीय अभिक्रियाओं में यदि दाब बढ़ाया जाए, तो गैस के अणुओं की सांद्रता बढ़ जाती है, जिससे अभिक्रिया की दर अधिक हो जाती है।
उदाहरण:
हैबर प्रक्रिया (Haber Process) में उच्च दाब पर अमोनिया का निर्माण तेजी से होता है।
6. सतह क्षेत्रफल (Surface Area) (ठोस अभिकारकों के लिए)
यदि कोई अभिकारक ठोस अवस्था में है, तो उसकी सतह क्षेत्रफल बढ़ाने से अभिक्रिया की दर तेज हो जाती है।
पाउडर रूप में ठोस की सतह क्षेत्रफल अधिक होती है, जिससे वह तेजी से प्रतिक्रिया करता है।
उदाहरण:
कोयला (Coal) के छोटे-छोटे टुकड़े तेजी से जलते हैं जबकि बड़े टुकड़े धीरे-धीरे जलते हैं।
7. हलचल (Stirring) और मिलावट (Mixing)
विलयन को हिलाने (Stirring) या मिलाने से अभिक्रिया की दर बढ़ जाती है क्योंकि इससे अणुओं का आपसी संपर्क बढ़ता है।
उदाहरण:
चाय में चीनी मिलाने के बाद चम्मच से हिलाने पर वह जल्दी घुल जाती है।
निष्कर्ष
अभिक्रिया की दर को प्रभावित करने वाले कारक तापमान, सांद्रता, उत्प्रेरक, दाब, सतह क्षेत्रफल, हलचल और अभिकारकों की प्रकृति हैं। इन कारकों को नियंत्रित करके विभिन्न रासायनिक प्रक्रियाओं की गति को बदला जा सकता है, जो वैज्ञानिक और औद्योगिक प्रयोगों में अत्यंत महत्वपूर्ण होता है।
02. (B) आप कैसे प्राप्त करेंगे?
(i) Carboxylic acids from acyl chlorides एसाइल क्लोराइड से कार्बोक्जिलिक एसिड
(ii) Carboxylic acids from aldehydes एल्डिहाइड से कार्बोक्जिलिक एसिड
(B) कार्बोक्जिलिक एसिड की प्राप्ति
कार्बोक्जिलिक अम्ल (
(R−COOH) को विभिन्न तरीकों से प्राप्त किया जा सकता है। यहाँ दो महत्वपूर्ण विधियाँ दी गई हैं:
(i) एसाइल क्लोराइड (Acyl Chlorides) से कार्बोक्जिलिक एसिड
एसाइल क्लोराइड (RCOCl) से जल अपघटन (Hydrolysis) द्वारा कार्बोक्जिलिक एसिड प्राप्त किया जा सकता है। यह अभिक्रिया जल या क्षारीय विलयन की उपस्थिति में होती है।
(a) जल द्वारा हाइड्रोलिसिस (Hydrolysis by Water)
इस अभिक्रिया में एसाइल क्लोराइड पानी के साथ अभिक्रिया करता है और कार्बोक्जिलिक एसिड तथा हाइड्रोक्लोरिक एसिड (HCl) बनाता है।
यह प्रक्रिया स्वाभाविक रूप से होती है लेकिन अम्लीय वातावरण में तेजी से पूरी होती है।
(b) क्षारीय (Alkaline) हाइड्रोलिसिस
यदि क्षार (NaOH) का प्रयोग किया जाए, तो कार्बोक्जिलेट आयन (RCOO⁻) बनता है।
इस कार्बोक्जिलेट को तेज़ाब (HCl) डालकर कार्बोक्जिलिक एसिड में परिवर्तित किया जाता है:
उदाहरण:
एथनॉयल क्लोराइड से एथेनॉइक एसिड (Acetyl Chloride to Acetic Acid)
(ii) एल्डिहाइड (Aldehydes) से कार्बोक्जिलिक एसिड
एल्डिहाइड (
(R−CHO) को ऑक्सीकरण (Oxidation) करके कार्बोक्जिलिक एसिड में बदला जा सकता है। इसके लिए विभिन्न ऑक्सीकरण अभिकर्मकों (Oxidizing Agents) का उपयोग किया जाता है।
(a) क्रोमियम आधारित ऑक्सीकरण (Chromium-based Oxidation)
(b) टोलेंस अभिक्रिया (Tollens' Reagent Test)
टोलेंस अभिकर्मक (AgNO₃ + NH₄OH) का उपयोग करके एल्डिहाइड को ऑक्सीकरण कर कार्बोक्जिलिक एसिड में बदला जाता है:
O→R−COOH+2Ag
इस अभिक्रिया में चाँदी का दर्पण (Silver Mirror) बनता है।
(c) फैहलिंग अभिक्रिया (Fehling's Test)
फैहलिंग अभिकर्मक (Fehling’s Solution - Cu²⁺ in alkaline medium) के साथ ऑक्सीकरण:
इस अभिक्रिया में लाल रंग का कॉपर(I) ऑक्साइड (Cu₂O) अवक्षिप्त होता है।
निष्कर्ष
एसाइल क्लोराइड से कार्बोक्जिलिक एसिड जल या क्षार के साथ हाइड्रोलिसिस द्वारा प्राप्त किया जाता है।
एल्डिहाइड से कार्बोक्जिलिक एसिड विभिन्न ऑक्सीकरण अभिक्रियाओं द्वारा प्राप्त किया जाता है, जैसे कि क्रोमियम ऑक्साइड, टोलेंस टेस्ट, और फैहलिंग टेस्ट।
ये विधियाँ कार्बोक्जिलिक एसिड की संश्लेषण प्रक्रिया में महत्वपूर्ण भूमिका निभाती हैं और जैविक तथा औद्योगिक क्षेत्रों में उपयोग की जाती हैं।
03. आणविक कोलाइट क्या है? एक लियोफिलिक कोलाइड एक लियोफोबिक को कैसे स्थिर करता है? इस संबंध में गोल्ड नम्बर का विवरण दीजिए।
आणविक कोलाइड (Molecular Colloid) क्या है?
आणविक कोलाइड (Molecular Colloid) वे कोलाइडल विलयन होते हैं जिनमें फैलाव अवस्था (Dispersed Phase) के कण आणविक आकार के होते हैं। ये कोलाइड मुख्य रूप से उच्च आणविक भार वाले यौगिकों से बने होते हैं, जो विलयन में छोटे लेकिन कोलाइडल आकार के कणों के रूप में बने रहते हैं।
आणविक कोलाइड के उदाहरण:
स्टार्च (Starch) का घोल
जेलाटिन (Gelatin) का घोल
प्रोटीन घोल (Protein Solution)
गोंद (Gum) का विलयन
लियोफिलिक कोलाइड, लियोफोबिक कोलाइड को कैसे स्थिर करता है?
कोलाइड को दो मुख्य प्रकारों में बाँटा जाता है:
लियोफिलिक कोलाइड (Lyophilic Colloid):
वे कोलाइड जिनमें फैलाव माध्यम (Dispersing Medium) के प्रति आकर्षण होता है।
ये स्वाभाविक रूप से स्थिर होते हैं और आसानी से पुनः प्राप्त किए जा सकते हैं।
उदाहरण: स्टार्च, गोंद, जैलाटिन, प्रोटीन।
लियोफोबिक कोलाइड (Lyophobic Colloid):
वे कोलाइड जिनमें फैलाव माध्यम के प्रति आकर्षण नहीं होता।
ये अस्थिर होते हैं और आसानी से अवक्षेपित हो सकते हैं।
उदाहरण: स्वर्ण सोल (Gold Sol), सिल्वर सोल, आर्सेनिक सल्फाइड सोल।
लियोफिलिक कोलाइड, लियोफोबिक कोलाइड को स्थिर कैसे करता है?
लियोफिलिक कोलाइड को संरक्षक कोलाइड (Protective Colloid) भी कहा जाता है, क्योंकि यह लियोफोबिक कोलाइड को स्थिर बना सकता है।
जब किसी लियोफोबिक कोलाइड में लियोफिलिक कोलाइड मिलाया जाता है, तो लियोफिलिक कोलाइड के कण लियोफोबिक कोलाइड के कणों की सतह को घेर लेते हैं।
इससे चार्ज स्थिरता (Charge Stability) बढ़ती है और अवक्षेपण (Precipitation) रोकता है।
यह प्रक्रिया कोलाइड को संरक्षण (Protection) प्रदान करती है।
उदाहरण:
गोल्ड सोल (Gold Sol) को जेलाटिन या स्टार्च मिलाकर स्थिर किया जाता है।
सिल्वर सोल (Silver Sol) को अल्ब्यूमिन के द्वारा स्थिर किया जाता है।
गोल्ड नम्बर (Gold Number) का विवरण
गोल्ड नम्बर (Gold Number) एक मात्रात्मक माप है, जो यह दर्शाता है कि किसी संरक्षक कोलाइड (Protective Colloid) की कितनी न्यूनतम मात्रा लियोफोबिक कोलाइड को स्थिर रखने के लिए आवश्यक होती है।
गोल्ड नम्बर की परिभाषा:
"गोल्ड नम्बर उस संरक्षक कोलाइड (mg में) की न्यूनतम मात्रा को कहते हैं, जो 10 ml गोल्ड सोल को 1 ml 10% NaCl विलयन की उपस्थिति में जमने (Coagulation) से बचा सकती है।"
गोल्ड नम्बर का महत्व:
कम गोल्ड नम्बर = अधिक संरक्षक क्षमता
(कम मात्रा में ही कोलाइड को स्थिर कर सकता है)
अधिक गोल्ड नम्बर = कम संरक्षक क्षमता
(अधिक मात्रा में जोड़ने पर ही कोलाइड स्थिर होगा)
गोल्ड नम्बर के उदाहरण:
संरक्षक कोलाइड गोल्ड नम्बर
जेलाटिन 0.005-0.01
अल्ब्यूमिन 0.1
स्टार्च 25
गोंद 0.15
निष्कर्ष:
आणविक कोलाइड वे कोलाइड होते हैं जिनमें फैलाव अवस्था के कण आणविक आकार के होते हैं।
लियोफिलिक कोलाइड, लियोफोबिक कोलाइड को स्थिर करने में मदद करते हैं।
गोल्ड नम्बर दर्शाता है कि किसी संरक्षक कोलाइड की कितनी न्यूनतम मात्रा किसी कोलाइड को स्थिर करने के लिए आवश्यक है।
कम गोल्ड नम्बर वाले कोलाइड अधिक प्रभावी संरक्षक होते हैं।
04 . (a) एक आदर्श गैस के लिए गतिज गैस समीकरण कैसे व्युत्पन्न करेंगे।
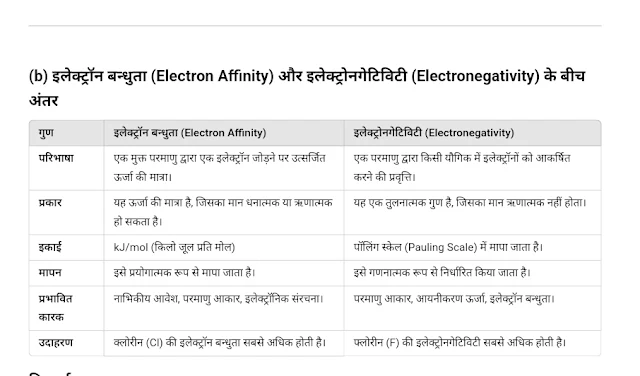
(b) इलेक्ट्रॉन बन्धुता और इलेक्ट्रोनगेटिविटी के बीच अंतर बताएं।
(a) एक आदर्श गैस के लिए गतिज गैस समीकरण का व्युत्पादन
गैसों के गतिज सिद्धांत (Kinetic Theory of Gases) के अनुसार, गैस के अणु यादृच्छिक गति में होते हैं और उनकी गति से गैस के विभिन्न गुणधर्म निर्धारित होते हैं। इस सिद्धांत का उपयोग करके गतिज गैस समीकरण व्युत्पन्न किया जाता है।
समीकरण का व्युत्पादन
1. मान्यताएँ (Assumptions of Kinetic Theory):
गैस के कण छोटे और कठोर गोले होते हैं।
उनके बीच कोई पारस्परिक आकर्षण बल नहीं होता।
वे कंटेनर की दीवारों से टकराकर प्रत्यास्थ (Elastic) टकराव करते हैं।
उनकी गति यादृच्छिक (Random) होती है।
गैस के सभी कणों की औसत गतिज ऊर्जा तापमान पर निर्भर करती है।
2. समीकरण का व्युत्पादन
मान लें कि गैस एक घनाकार कंटेनर में बंद है जिसकी हर भुजा L है।
यदि कणों की संख्या
𝑁
N है, तो कुल बल (Force)
यह गतिज गैस समीकरण (Kinetic Gas Equation) है।
निष्कर्ष
इलेक्ट्रॉन बन्धुता दर्शाती है कि एक परमाणु इलेक्ट्रॉन को ग्रहण करने पर कितनी ऊर्जा उत्सर्जित करता है।
इलेक्ट्रोनगेटिविटी दर्शाती है कि किसी अणु में एक परमाणु बाँध में साझा किए गए इलेक्ट्रॉनों को अपनी ओर कितना आकर्षित करता है।
दोनों गुणधर्म परमाणु के रासायनिक व्यवहार को निर्धारित करने में महत्वपूर्ण भूमिका निभाते हैं।
05. (a) लुईस अम्ल और क्षार अवधारणा पर चर्चा करें।
(b) न्यूक्लियोफाइल और इलेक्ट्रोफाइल के बीच क्या अंतर है?
(a) लुईस अम्ल और क्षार अवधारणा पर चर्चा करें
लुईस अम्ल और क्षार की परिभाषा
गिल्बर्ट एन. लुईस (Gilbert N. Lewis) ने 1923 में अम्ल और क्षार (Acid & Base) की एक नई परिभाषा दी, जिसे लुईस अवधारणा कहा जाता है।
लुईस अम्ल (Lewis Acid): वह पदार्थ जो इलेक्ट्रॉन युग्म को स्वीकार (Accept) करता है।
लुईस क्षार (Lewis Base): वह पदार्थ जो इलेक्ट्रॉन युग्म को दान (Donate) करता है।
लुईस अम्ल के उदाहरण:
BF³ (बोरोन ट्राइफ्लोराइड): इसमें बोरोन केवल 6 इलेक्ट्रॉनों से घिरा होता है और यह एक अतिरिक्त इलेक्ट्रॉन युग्म ग्रहण कर सकता है।
Alcl3(एल्युमिनियम क्लोराइड): यह इलेक्ट्रॉन युग्म स्वीकार करके स्थिरता प्राप्त करता है।
H+(हाइड्रोजन आयन): यह बिना किसी इलेक्ट्रॉन के होता है, इसलिए इलेक्ट्रॉन युग्म को ग्रहण करता है।
लुईस क्षार के उदाहरण:
NH3 (अमोनिया): इसमें नाइट्रोजन पर एक मुक्त इलेक्ट्रॉन युग्म होता है, जिसे यह दान कर सकता है।
OH-(हाइड्रॉक्साइड आयन): इसमें भी अतिरिक्त इलेक्ट्रॉन युग्म होता है।
Cl- (क्लोराइड आयन): इसमें भी एक अतिरिक्त इलेक्ट्रॉन युग्म होता है, जिससे यह लुईस क्षार के रूप में कार्य करता है।
लुईस अम्ल और क्षार अभिक्रिया का उदाहरण
लुईस अवधारणा का महत्व:
यह आयनिक और अणुगत अभिक्रियाओं को समझने में मदद करता है।
यह धातु-लिगैंड जटिल यौगिकों (Metal-Ligand Complexes) को समझने के लिए उपयोगी है।
यह एसिड-बेस अभिक्रियाओं का विस्तृत दृष्टिकोण प्रदान करता है।
उदाहरण अभिक्रियाएँ:
इलेक्ट्रोफिलिक प्रतिस्थापन (Electrophilic Substitution):
इलेक्ट्रोफाइल है, जो बेंजीन रिंग पर आक्रमण करता है।
निष्कर्ष
लुईस अवधारणा अम्ल और क्षार को इलेक्ट्रॉन ग्रहण और दान के आधार पर परिभाषित करती है।
न्यूक्लियोफाइल वे कण होते हैं जो इलेक्ट्रॉन प्रदान करते हैं, जबकि इलेक्ट्रोफाइल वे कण होते हैं जो इलेक्ट्रॉन ग्रहण करते हैं।
ये दोनों अवधारणाएँ रासायनिक अभिक्रियाओं में इलेक्ट्रॉन प्रवाह को समझने में मदद करती हैं।

.png)















%20(31).jpg)

.jpg)

.png)
%20(31).jpg)

